A origem da palavra átomo
A palavra átomo foi utilizada pela primeira vez na Grécia antiga, por
volta de 400 aC. Demócrito (um filósofo grego) acreditava que todo tipo de
matéria fosse formado por diminutas partículas que denominou átomos (sem
divisão). Acreditava-se que tais partículas representavam a menor porção de matéria
possível, ou seja, eram indivisíveis. Como esta idéia não pôde ser comprovada
por Demócrito e seus contemporâneos, ela ficou conhecida como 1º modelo
atômico, mas meramente filosófico.
Modelo Atômico de
Dalton
 As idéias de Demócrito permaneceram
inalteradas por aproximadamente 2200 anos. Em 1808, Dalton retomou estas
idéias sob uma nova perspectiva: a experimentação.
As idéias de Demócrito permaneceram
inalteradas por aproximadamente 2200 anos. Em 1808, Dalton retomou estas
idéias sob uma nova perspectiva: a experimentação.
Baseado em reações químicas e pesagens minuciosas, chegou à conclusão de
que os átomos realmente existiam e que possuíam algumas características:
- Toda matéria é formada por diminutas partículas esféricas, maciças,
neutras e indivisíveis chamadas átomos.
 Existe um número finito de tipos de átomos na natureza. A combinação de iguais ou diferentes tipos de átomos originam os
diferentes materiais.
Existe um número finito de tipos de átomos na natureza. A combinação de iguais ou diferentes tipos de átomos originam os
diferentes materiais.
Modelo Atômico de
Thomson (1898)
Com a descoberta dos prótons e elétrons, Thomson propôs um modelo
de átomo no qual os elétrons e os prótons, estariam uniformemente distribuídos,
garantindo o equilíbrio elétrico entre as cargas positiva dos prótons e
negativa dos elétrons.
Modelo Atômico de Rutherford (1911)
Rutherford bombardeou uma fina lâmina de ouro (0,0001 mm) com partículas
"alfa" (núcleo de átomo de hélio: 2 prótons e 2 nêutrons), emitidas
pelo "polônio" (Po), contido num bloco de chumbo (Pb), provido de uma
abertura estreita, para dar passagem às partículas "alfa" por ele
emitidas Envolvendo a lâmina de ouro (Au), foi colocada uma tela protetora
revestida de sulfeto de zinco (ZnS).
Modelo Atômico de
Rutherford (1911)
Observando as cintilações na tela de ZnS, Rutherford verificou que
muitas partículas "alfa" atravessavam a lâmina de ouro, sem sofrerem
desvio, e poucas partículas "alfa" sofriam desvio. Como as partículas
"alfa" têm carga elétrica positiva, o desvio seria provocado por um
choque com outra carga positiva, isto é, com o núcleo do átomo,
constituído por prótons.
Modelo Atômico de
Rutherford (1911)
Assim, o átomo seria um imenso vazio, no qual o núcleo ocuparia uma
pequena parte, enquanto que os elétrons o circundariam numa região negativa
chamada de eletrosfera, modificando assim, o modelo atômico proposto por
Thomson.
- Os Postulados de Niels Bohr (1885-1962) De
acordo com o modelo atômico proposto por Rutherford, os elétrons ao
girarem ao redor do núcleo, com o tempo perderiam energia, e se chocariam
com o mesmo. Como o átomo é uma estrutura estável, Niels Bohr formulou uma
teoria (1913) sobre o movimento dos elétrons, fundamentado na Teoria Quântica
da Radiação (1900) de Max Planck.A teoria de Bohr fundamenta-se nos seguintes
postulados: 1º postulado: Os elétrons descrevem órbitas circulares
estacionárias ao redor do núcleo, sem emitirem nem absorverem energia.
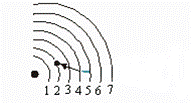
Órbitas de Bohr para o átomo de hidrogênio
Segundo postulado de Bohr. Um átomo irradia energia quando
um elétron salta de
uma órbita de maior energia para
uma de menor energia.O comprimento de onda guarda relação com a energia.
Os menores comprimentos de onda de luz significam vibrações mais rápidas e
maior energia.
 O comprimento de onda guarda relação com a energia.
Os menores comprimentos de onda de luz significam vibrações mais rápidas e
maior energia.
O comprimento de onda guarda relação com a energia.
Os menores comprimentos de onda de luz significam vibrações mais rápidas e
maior energia.
 O comprimento de onda guarda relação com a energia.
Os menores comprimentos de onda de luz significam vibrações mais rápidas e
maior energia.
O comprimento de onda guarda relação com a energia.
Os menores comprimentos de onda de luz significam vibrações mais rápidas e
maior energia.
A linha vermelha no
espectro atômico é causada por elétrons saltando da terceira órbita para a segunda órbita
A linha verde-azulada
no espectro atômico é causada por elétrons saltando da quarta para a segunda órbita.

A linha azul no
espectro atômico é causada por elétrons saltando da quinta para a segunda órbita
A linha violeta
mais brilhante no espectro atômico é causada por elétrons saltando da sexta para a segunda órbita.
Teoria Quântica
De acordo com Max
Planck (1900), quando uma partícula passa de uma situação de maior energia para
outra de menor energia ou vice-versa, a energia é perdida ou recebida em "pacotes"
que recebe o nome de quanta(quantum é o singular de
quanta)
O quantum é o pacote
fundamental de energia e é indivisível. Cada tipo de energia tem o seu quantum.A
Teoria Quântica permitiu a identificação dos elétrons de um determinado átomo,
surgindo assim os "números quânticos".
Modelo atômico atual
Princípio da incerteza de
Heisenberg: é impossível determinar com precisão a posição e a
velocidade de um elétron num mesmo instante.
Orbital é a região onde é
mais provável encontrar um életron.























Postar um comentário